 Por primera vez, un equipo de científicos ha encontrado un vínculo entre las bacterias intestinales y la enfermedad de Parkinson. Su estudio en ratones señala al microbioma como una clave para el deterioro motor típico de este trastorno neurodegenerativo. Los autores advierten que los antibióticos o los trasplantes de microbios fecales aún están lejos de ser terapias viables para humanos.
Por primera vez, un equipo de científicos ha encontrado un vínculo entre las bacterias intestinales y la enfermedad de Parkinson. Su estudio en ratones señala al microbioma como una clave para el deterioro motor típico de este trastorno neurodegenerativo. Los autores advierten que los antibióticos o los trasplantes de microbios fecales aún están lejos de ser terapias viables para humanos.
Los enfermos de párkinson suelen tener problemas digestivos años antes de sufrir los primeros síntomas de su enfermedad. Se ha especulado con que esta dolencia neurodegenerativa nazca en las tripas y viaje más tarde al cerebro, pero nadie ha conseguido una prueba fehaciente de este extraño vínculo. Hasta hoy, cuando un equipo de investigadores estadounidenses ha dado a conocer en la revista Cell los resultados de su trabajo. Según han comprobado en ratones genéticamente predispuestos a la enfermedad de Parkinson, los microbios intestinales pueden desempeñar un papel esencial en los trastornos del movimiento típicos de esta dolencia.
En sus ensayos con roedores que sirven de modelo para la enfermedad, el tratamiento con antibióticos redujo los déficits motores y las características moleculares de la patología, mientras que el trasplante de microbios intestinales de pacientes enfermos exacerbó sus síntomas.
Los científicos, investigadores del Instituto de Tecnología de California (EE UU), consideran que estos hallazgos podrían conducir a nuevas estrategias de tratamiento para la segunda enfermedad neurodegenerativa más común en el país norteamericano.
El tratamiento con antibióticos redujo los déficits motores en los ratones
“Por primera vez hemos descubierto un vínculo entre el microbioma intestinal y el párkinson”, explica Sarkis Mazmanian, uno de los autores del trabajo, que insiste en que las enfermedades neurodegenerativas podrían tener su origen en el intestino y no solo en el cerebro.
“El descubrimiento de que los cambios en el microbioma pueden estar involucrados en la enfermedad de Parkinson es un cambio de paradigma y abre nuevas posibilidades para el tratamiento de los pacientes», añade.
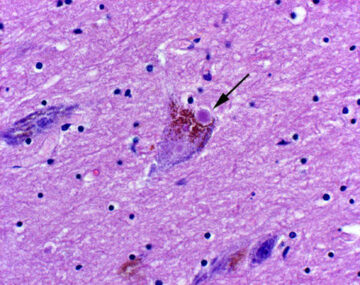
La enfermedad de Parkinson es causada por la acumulación en las neuronas de proteínas α-sinucleína anormales, lo que ocasiona efectos particularmente tóxicos en las células que liberan dopamina en las regiones cerebrales que controlan el movimiento.
Como resultado, los pacientes experimentan temblores, rigidez muscular, lentitud de movimiento y deterioro al caminar. Las terapias actuales se centran en aumentar los niveles de dopamina en el cerebro, pero estos tratamientos pueden causar efectos secundarios graves y a menudo pierden efectividad con el tiempo.
Para abordar la necesidad de tratamientos más seguros y eficaces, los investigadores empezaron a analizar la microbiota intestinal y observaron que los pacientes poseen una flora alterada, con problemas gastrointestinales y alteraciones como estreñimiento, que con frecuencia degeneran en déficits motores en estos individuos.
Pero, aunque se ha demostrado que los microbios intestinales influyen en el desarrollo neuronal, capacidades cognitivas, ansiedad, depresión y autismo, hasta ahora la evidencia científica sobre su papel en las enfermedades neurodegenerativas ha sido escasa.
Posible diana terapéutica
El experimento se realizó en ratones modificados genéticamente con una enfermedad de tipo párkinson que vivían en jaulas normales, no estériles o en un ambiente libre de gérmenes. Los ratones criados en las jaulas libres de gérmenes mostraron menos déficit motores y menos agregados de proteína α-sinucleína mal plegada en las regiones del cerebro involucradas en el control del movimiento.
De hecho, estos ratones mostraron un rendimiento casi normal en tareas como recorrer una viga, retirar un adhesivo de su nariz o descender por un poste. El tratamiento con antibióticos tuvo un efecto similar al ambiente libre de gérmenes en la mejora de los síntomas motores en ratones predispuestos a estos trastornos.
Los microbios intestinales empeoran los síntomas al crear un ambiente que favorece la acumulación de proteína mal plegada
Por el contrario, los ratones criados en las jaulas libres de gérmenes mostraron peores síntomas motores cuando fueron tratados con metabolitos microbianos, llamados ácidos grasos de cadena corta, o recibieron trasplantes fecales de microbios intestinales de pacientes afectados.
Es importante señalar que, en este estudio, los microbios intestinales cooperan con un factor genético específico para influir en el riesgo de desarrollar la enfermedad –los investigadores utilizaron un modelo específico de ratón–. De hecho, los roedores genéticamente normales no desarrollaron síntomas motores después de recibir trasplantes fecales de pacientes.
Los resultados indican que ciertos microbios intestinales empeoran los síntomas motores al crear un ambiente que podría favorecer la acumulación de agregados de proteína mal plegados.
Sin embargo, los antibióticos o los trasplantes de microbios fecales están lejos de ser terapias viables en este momento. «El uso de antibióticos como los que utilizamos en este estudio posee riesgos para los seres humanos, como defectos en la función inmunitaria y metabólica», advierten los autores. «Todavía no tenemos datos sobre qué especies son problemáticas o beneficiosas en párkinson».
“La identificación de especies microbianas o metabolitos alterados en la enfermedad de Parkinson puede servir como biomarcador o incluso diana de posibles fármacos”, concluye el grupo de expertos.
SINC